پیوند فلزی
معرفی این صفحه اتصال در فلزات. این توضیح میدهد که چگونه پیوند فلزی شکل میگیرد و به همین دلیل قدرت آن متفاوت بوده و از فلز به فلز.
چه باند فلزی؟
پیوند فلزی در سدیم
تمایل به فلزات دارای نقاط ذوب بالا و نقطه جوش نشان می دهد مناسبات مستحکم بین اتم. حتی یک فلز مانند سدیم (نقطه ذوب 97.8 درجه سانتیگراد) ذوب در درجه حرارت قابل ملاحظه ای بالاتر از این عنصر (نئون) آن پیش می آید که در جدول تناوبی.
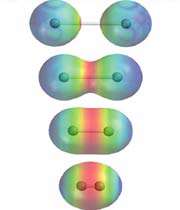
سدیم تا به ساختار الکترونی 1s22s22p63s1. هنگامی که اتم های سدیم گرد هم می آیند ، الکترون در اوربیتال 3s اتمی از یک اتم به اتم سدیم فضای سهام با الکترون در یک اتم مربوط همسایه به شکل مولکولی مداری -- در حد مرتب کردن بر اساس همان راه است که یک پیوند کووالانسی تشکیل می شود.
تفاوت ، با این حال ، این است که هر اتم سدیم است که توسط هشت اتم سدیم دیگر را لمس کرد -- و به اشتراک گذاری رخ می دهد بین اتم مرکزی و اوربیتال 3s در تمام هشت اتم های دیگر. و به همین ترتیب و به همین ترتیب ، تا زمانی که شما در همه اتمها در آن توده سدیم گرفته شده است -- و هر یک از این هشت است به نوبه خود توسط اتم های سدیم هشت ، که به نوبه خود با هشت اتم ها را لمس لمس می باشد.
همه اوربیتال 3s در تمام اتم همپوشانی به دادن تعداد زیادی از اوربیتال مولکولی که بیش از کل قطعه از فلز ادامه یافته است. باید تعداد زیادی از اوربیتال ، مولکولی البته ، چون هر اوربیتال تنها دو الکترون را می توانید نگه دارید وجود دارد.
الکترون ها می توانند آزادانه حرکت در درون این اوربیتال مولکولی ، و بنابراین هر الکترون از یک اتم می شود پدر و مادر خود جدا شده. الکترون ها گفته می شود delocalised. این فلز را با هم توسط نیروهای قوی از جاذبه بین هسته های مثبت و الکترون delocalised برگزار می شود.
این است که گاهی اوقات به عنوان "مجموعه ای از یونهای مثبت در دریایی از الکترون ها" توصیف کرد.
اگر شما قصد استفاده از این دیدگاه ، مراقب باشید! آیا یک فلز تا از اتم یا یون های ساخته شده؟ این اتم ها ساخته شده است.
هر مرکز مثبت در نمودار نشان دهنده تمام بقیه اتم جدا از الکترونی خارجی خود ، اما این الکترون از دست داده نشده است -- که دیگر ممکن است وابستگی به یک اتم خاص ، اما هنوز هم وجود دارد در ساختار. سدیم نیست -- فلز سدیم است بنابراین به عنوان سدیم نوشته شده است.
پیوند فلزی در منیزیم
اگر شما را از طریق استدلال همین کار را با منیزیم کار ، شما را تا پایان با اوراق قرضه قوی تر است و بنابراین نقطه ذوب بالاتر است.
منیزیم است بیرونی 3s2 ساختار الکترونیکی. هر دوی این الکترونها تبدیل delocalised ، تا "دریا" دو بار آن را به عنوان چگالی الکترونی در سدیم انجام می دهد. باقی مانده "یون" همچنین دو بار به جرم (در صورتی که می خواهید به استفاده از این دیدگاه خاصی از پیوند فلزی) و غیره وجود خواهد داشت بیشتر جاذبه بین "یون" و "دریا".
بیشتر در واقع ، هر اتم منیزیم یکی بیشتر پروتون در هسته از اتم سدیم است ، و بنابراین نه تنها وجود خواهد داشت تعداد بیشتری از الکترون delocalised ، اما نیز وجود داشته باشد جاذبه بیشتری برای آنها.
اتم منیزیم را کمی کوچکتر از شعاع اتم های سدیم ، و به همین ترتیب الکترونهای delocalised هستند و نزدیک به هسته. هر اتم منیزیم همچنین دارای دوازده همسایگان نزدیک به جای سدیم هشت. هر دوی این عوامل افزایش قدرت باند هنوز هم بیشتر.
پیوند فلزی در عناصر گذار
فلز انتقالی تمایل دارند که به ویژه نقطه ذوب بالا و نقطه جوش. دلیل آن این است که آنها می توانند الکترون ها در 3d delocalisation و همچنین 4S شامل شود. الکترون ها بیشتر به شما می تواند شامل ، قوی تر از جاذبه های تمایل به.
توجه : اگر شما خوشحال ساختار الکترونی فلزات گذار نیست ، پس شما ممکن است مانند این لینک به آن تجدید نظر به دنبال دارد.
پیوند فلزی در فلزات مذاب
در فلز مذاب ، پیوند فلزی است هنوز حاضر ، اگر چه ساختار دستور داده شده است شکسته شده. پیوند فلزی است تا فلز جوش به طور کامل نمی شکسته. این بدان معناست که نقطه جوش است که در واقع راهنمای بهتر و بیشتر به قدرت پیوند فلزی از نقطه ذوب است. در ذوب ، پیوند سست است ، شکسته نمی شود.
مشخصات وب
برای ذخیره کردن مطالب
ابتدا (CTRL+A)رابزنید و سپس
CTRL+C رابزنید
در آخر در هر جایی که خواستید ،مانند ورد ...و PASTEکنید
یاCTRL +V
را بزنید